Praktikum Teknologi Farmasi Steril
Analisis Sediaan Bedak Tabur Steril
❤ Judul : Pencucian Dan Sterilisasi Alat Dan Pengemas
Tujuan:
Tujuan:
- Mahasiswa mampu memahami fungsi pencucian alat dan pengemas sediaan steril
- Mahasiswa mampu memahami proses sterilisasi alat dan bahan pengemas
- Mahasiswa mampu memahami konsep sterilisasi
- Mahasiswa mampu memahami fungsi setiap bahan yang digunakan dalam proses sterilisasi
- Mahasiswa mampu membandingkan efektivitas sterilisasi melalui peningkatan suhu dan waktu
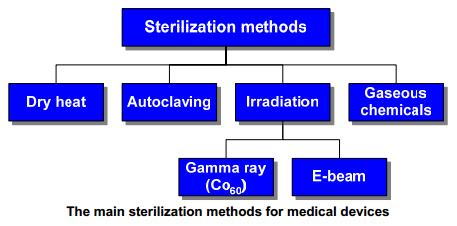
Gambar 1. Metode sterilisasi yang umum digunakan dalam sediaan dan peralatan medis
Prosedur Kerja- Sortasi alat berdasarkan kategorinya (gelas, plastik, karet, logam, dsb) Pencucian alat gelas Cuci dengan HCl encer → rendam dalam larutan detergen 1% dan Na2CO3 0,1% selama 15 menit → didihkan dalam air panas selama 15 menit → amati hingga air/cairan jernih → jika belum jernih ulangi proses pendidihan → bilas dengan akuades. Pencucian alat logam Didihkan dalam larutan detergen 1% selama 10 menit → rendam dalam Na2CO3 5% selama 5 menit → didihkan dalam air panas selama 15 menit → bilas dengan akuades. Pencucian karet/plastik Dilakukan sama dengan alat gelas namaun HCl yang digunakan adalah HRl 2% dan pada akhirnya dibilas dengan alcohol 70%. Rendam dalam HCl 2% selama 2 hari → rendam dalam larutan detergen 1% dan Na2CO3 0,1% selama 15 menit → amati hingga cairan jernih → jika belum jernih lakukan perendaman di dalam detergen dan natrium bikarbonat → didihkan dalam air panas selama 15 menit → rendam dalam etanol 70% selama 10 menit → amati hingga larutan jernih. CATATAN: Penggunaan cairan (volumenya) disesuaikan dengan wadah dan alat yang dicuci.
- Alat yang tahan panas dikeringkan di dalam oven 100 – 105oC selama 10 menit dalam kondisi yang memungkinkan cairan keluar. Alat yang tidak tahan panas dikeringkan dengan tisu.
- Sebelum alat-alat dimasukkan ke dalam autoklaf dan oven alat-alat tersebut dibungkus menggunakan kertas perkamen atau kertas kopi. Untuk alat yang memiliki mulut harus disumbat dahulu dengan kapas atau ditutup dengan kertas perkamen. Tiap alat dibungkus rangkap dua pembungkus.
- Untuk alat yang memiliki rongga tutup mulut rongga dengan kertas perkamen lalu dikaret/ditali. Ampul dan vial ditutup dengan aluminium foil hingga rapat. Alat yang lain dibungkus dengan kertas/kertas saring. Tiap alat dibungkus dengan rangkap dua pembungkus.
- Sterilisasi alat Alat yang tahan panas kering disterilisasi menggunakan oven dengan suhu 180oC (pastikan suhu telah mencapai 180oC) selama 30 menit. Alat yang tidak tahan panas kering disterilisasi menggunakan autoklaf dengan suhu 121oC selama 15 menit. Sedangkan alat-alat karet disterilisasi cukup dengan direndam menggunakan alcohol 70%.
- Jangan keluarkan alat dari pembungkusnya, simpan pada tempat yang bersih.
- Kemudian bilas dengan WFI steril, teteskan pada media agar. Inkubasi 24 jam, lihat pertumbuhan mikroba, bandingkan efektivitas peningkatan lama waktu sterilisasi.
- Lakukan perhitungan nilai D value dan Z value masing-masing alat. Keterangan : terjadi pengurangan bakteri dari 10.000 ke 1.000 atau pengurangan 90% (satu pengurangan log).
PEMBAHASAN
Sediaan dan barang dinyatakan steril jika semuanya bebas dari bentuk hidup mikroorganisme, yang dapat dibuktikan melalui persyaratan pada “ pengujian terhadap sterilitas”. Kemasan steril menuntut kondisi yang steril dalam hal persiapan maupun proses pembuatannya. Sterilisasi kemasan ini digunakan terutama untuk sediaan steril dan bersifat mutlak, artinya kemasan harus steril dan tidak bisa sedikit steril. Hal ini karena penggunaan sediaan steril langsung menembus mekanisme pertahanan tubuh alami seperti kulit dan mukus. Jika obat yang diberikan tidak steril dikhawatirkan akan menimbulkan penyakit akibat mikroorganisme dari obat yang diberikan sehingga terjadi infeksi atau kerusakan jaringan.
❤ Judul : Validasi
Tujuan:
Sediaan dan barang dinyatakan steril jika semuanya bebas dari bentuk hidup mikroorganisme, yang dapat dibuktikan melalui persyaratan pada “ pengujian terhadap sterilitas”. Kemasan steril menuntut kondisi yang steril dalam hal persiapan maupun proses pembuatannya. Sterilisasi kemasan ini digunakan terutama untuk sediaan steril dan bersifat mutlak, artinya kemasan harus steril dan tidak bisa sedikit steril. Hal ini karena penggunaan sediaan steril langsung menembus mekanisme pertahanan tubuh alami seperti kulit dan mukus. Jika obat yang diberikan tidak steril dikhawatirkan akan menimbulkan penyakit akibat mikroorganisme dari obat yang diberikan sehingga terjadi infeksi atau kerusakan jaringan.
❤ Judul : Validasi
Tujuan:
- Mahasiswa mampu memahami cara yang dapat dilakukan untuk sterilisasi ruangan steril
- Mahasiswa mampu memahami tahapan-tahapan dalam proses validasi metode sterilisasi
Prosedur Kerja
A. Validasi Metode Sterilisasi dengan Autoklaf- Infus, ampul dan vial yang telah dibersihkan diberi akuades secukupnya.
- Masing-masing sediaan diautoklaf dengan suhu 121°C selama 15 menit.
- Preparasi media agar di dalam kotak aseptis.
- Keluarkan sediaan dari autoklaf, pastikan masih terhindar dari kontak udara luar sampai masuk ke dalam kotak aseptis.
- Cek sterilitas akuades di dalam sediaan dengan media agar dengan meneteskan secukupnya pada permukaan dan meratakannya.
- Inkubasi media yang telah diisi sampel selama 24 jam.
B. Validasi Kotak Aseptis.
Untuk udara di dalam kotak aseptis.
- Piring Petri yang telah berisikan media diletakkan di dalam kotak aseptis dekat dengan sumber udara masuk selama 10 menit.
- Inkubasi media selama 24 jam dan amati ada tidaknya biakkan.
Untuk dinding kotak aseptis.
- Buatlah media agar yang agak cembung.
- Tempelkan bagian yang cembung pada dinding kotak septis selama kurang lebih 1 menit.
- Inkubasi media selaam 24 jam, amati ada tidaknya biakkan.
C. Validasi Metode Sterilisai dengan Oven
- Wadah vial dan ampul masing-masing 2 buah dibungkus dengan aluminium foil disterilkan pada suhu 180°C selama 30 menit.
- Masing-masing wadah dibilas dengan Water for Injection (WFI) pada bagian dalamnya dan hasil bilasan dimasukkan dalam media agar.
- WFI yang tidak dimasukkan ke dalam wadah digunakan sebagai kontrol.
- Inkubasi media selama 24 jam, amati ada tidaknya biakkan.
PEMBAHASAN
Setelah dilakukannya praktikum ini maka dapat dibuktikan bahwa setiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan, atau mekanisme yang digunakan dalam produksi dan pengawasan senantiasa tervalidasi. Proses sterilisasi yang benar akan menghasilkan suatu produk dan sediaan yang steril. Hal tersebut dapat dipastikan dengan cara melakukan validasi. Validasi wajib dilakukan terhadap semua produk sebelum produk tersebut dipasarkan.
❤ Judul : Pembuatan Bedak Tabur
Tujuan :
- Mahasiswa mampu memahami konsep sterilisasi dalam pembuatan sediaan steril
- Mahasiswa mampu memahami kegunaan zat aktif dan eksipien dalam sediaan bedak tabur steril.
- Mahasiswa mampu memahami prosedur kerja dalam pembuatan sediaan bedak tabur steril.
- Mahasiswa mampu mengevaluasi sediaan bedak tabur steril yang dihasilkan.
Analisis Sediaan Bedak Tabur Steril
1. Evaluasi Organoleptis
Diamati organoleptisnya berupa warna, bau, dan kehalusan serbuk lalu dicatat.
2. Keseragaman Ukuran
Sediaan diayak pada ayakan mesh 20, lalu timbang dancatat bobot serbuk tabur yang terayak.
3. Homogenitas Partikel
Sediaan diayak dengan ayakan yang telah ditentukan, Semua serbuk tersebut harus dapat melewati ayakan tersebut.
4. Sifat Alir Bedak
Uji dilakukan dengan mengukur waktu yang diperlukan oleh sejumlah tertentu zat untuk mengalir melalui lubang-lubang corong.
5. Luas Permukaan
1 g serbuk disuspensikan dengan 1 ml air, teterskan sampel diatas preparat lalu dikeringkan. Amati preparat dibawah mikroskop. Hitung diameter dan luas permukan.
6. Uji Pengemas Kaleng/Plastik
Uji dilakukan dengan menganalisis kebocoran pada tube salep yang digunakan. Aquadest yang volumenya telah dicatat dimasukkan ¾ bejana, lalu ditambahkan metilen blue 1%. Pengemas dicelupan kedalamnya, diamkan selama 30 menit dan amati ada atau tidaknya perubahan warna kebiruan pada sediaan.
7. Uji Kualitatif dan Kuantitatif Sediaan
Lakukan telaah literature mengenai cara pengujian kualitatif dan kuantitatif dari zat aktif yang anda gunakan.
8. Uji Sterilitas
Menggunakan medium agar NA dan PDA. Tuang cairan agar NA (bakteri) dan PDA (jamur) pada dua cawan petri yang berbeda. Biarkan mengeras. Bagi media plat menjjadi 2 bagian area dan tandai dengan spidol marker. Buatlah sumur pada media agar NA dan PDA. Lalu letakkan sediaan pada sumur tersebut. Inkubasi selama 3-4 hari. Media NA pada suhu 35-37OC dan PDA pada suhu 20-25oC. Hitung jumlah bakteri/jamur yang terdapat pada media agar menggunakan perhitungan ALT.
PEMBAHASAN
Umumnya serbuk tabur harus melewati ayakan dengan derajat halus 100 mesh agar tidak menimbulkan iritasi pada bagian yang peka. Bahan yang digunakan pada pembuatan serbuk tabur harus bebas dari bakteri. Serta, serbuk tabur tidak boleh digunakan untuk luka terbuka. Farmakologi dari sediaan serbuk tabur yaitu ketika serbuk tabur dipakai pada kulit, serbuk akan melalui folikel rambut, kelenjar keringat atau kelenjar lemak, atau sel-sel selaput ke lapisan epidermis. Setelah itu serbuk akan diadsorpsi, adsorbsi adalah penyerapan partikel hanya terdapat pada permukaan saja. Adsorpsi serbuk pada umumnya disebabkan oleh penetrasi melalui stratus corneum dan kenaikan suhu pada kulit dapat menambah kemampuan penetran zat yang dipakai.
Pada saat serbuk tabur di adsorbsi maka akan masuk ke dalam lapisan kulit yang telah teriritasi oleh jamur, bakteri dan bahkan akibat peradangan dan kerusakan lapisan kulit tanduk. Bahan-bahan dalam serbuk tabur akan ikut teradsorbsi dan menghasilkan efek terapi dari gejala-gejala tersebut. Asam sitrat akan diadsorbsi pada lapisan kulit yang teriritasi oleh bakteri dan peradangan pada lapisan kulit. Bahan ini akan membunuh bakteri. setelah itu, akan menghasilkan efek antiseptikum. Antiseptikum adalah zat yang digunakan untuk membunuh atau mencegah pertumbuhan mikroorganisme, biasanya merupakan sediaan yang digunakan pada jaringan hidup. Dan efek keratelotik yang bersifat menguraikan keratin dan antiinflamasi
❤ Judul : Pembuatan Salep Mata Steril
Tujuan :
- Mahasiswa mampu memahami pengaruh bahan aktif dan eksipien dalam penentuan metode sterilisasi yang digunakan untuk formulasi steril.
- Mahasiswa mampu membuat sediaan salep mata dengan metode sterilisasi yang sesuai.
PEMBAHASAN
Sediaan dibuat dari bahan yang sudah disterilkan dengan perlakuan aseptik yang ketat serta memnuhi syarat uji sterilitas. Keuntungan salep mata penambah waktu hubungan anatara obat dengan obat dengan mata, dua sampai empat kali lebih besar apabila dipakai salep dibandingkan jika dipakai larutan garam. Oculenta atau yang biasa disebut salep mata, adalah sediaan setengah padat. Salep mata adalah salep yang digunakan pada mata. Pada pembuatan salep mata harus diberikan perhatian khusus. Keuntungan utama suatu salep mata dibandingkan larutan untuk mata adalah waktukontak antara obat dengan mata yang lebih lama. Sediaan salep mata umumnya dapatmemberikan bioavailabilitas lebih besar daripada sediaan larutan dalam air yang ekuivalen. Hal ini disebabkan karena waktu kontak yang lebih lama sehingga jumlah obat yang diabsorbsi lebih tinggi. Satu kekurangan bagi pengguna salep mata adalah kaburnyapandangan yang terjadi begitu dasar salep meleleh dan meyebar melalui lensa mata.
❤ Judul : Uji Alkalinitas Gelas
Tujuan :
Prosedur Kerja
Untuk membuat agar kemasan gelas bersifat inert dan netral maka gelas dicelupkan dalam larutan asam. Untuk melinDungi permukaan gelas maka diberi laminasi silikon polietilen glikol atau polietilen stearat. Sifat gelas yang stabil menyebabkan gelas dapat disimpan dalam jangka waktu panjang tanpa kerusakan. Uji alkalinitas sangatlah penting karena gelas yang dipakai sebagai wadah untuk injeksi harus dapat menjaga pH larutan sehingga tidak menaikkan pH karena pengeluaran alkali, oleh karenanya gelas harus bersifat netral. Wadah yang telah mengalami perubahan fisika- kimia sehingga menyebabkan mungkin tidak lagi memenuhi syarat. Syarat yang lain untuk wadah sediaan injeksi yaitu untuk ampul harus mudah dilebur, pada waktu menutup ampul, tidak mudah pecah, dan untuk ampul pada waktu dipotong tidak mengeluarkan pecahan gelas yang lembut.
- Mahasiswa mampu mengetahui ketahanan gelas terhadap serangan kimiawi preparat farmasi yang disimpan dalam botol gelas
- Mahasiswa mampu memahami pengujian kualitas gelas
- Mahasiswa mampu menjelaskan tipe gelas yang dipakai dalam formulasi sediaan steril.
- Mahasiwa mampu menganalisis hasil yang didapatkan dari hasil pengujian kualitas kaca.
- Mahasiswa mampu menentukan kualitas kaca yang akan digunakan dari hasil percobaan.
- Mahasiswa mapu menginterpretasikan hasil analisis sediaan yang didapatkan.
Prosedur Kerja
A. Uji serbuk kaca
- Pilih secara acak 6 atau lebih wadah kaca, bilas dengan WFI, keringkan
- Tumbuk kaca, hancurkan sehingga bisa lewat ayakan no.12
- Haluskan kembali kaca yang terlewat dengan ayakan no.14, hingga diperoleh serbuk yang lolos sebanyak 20 gram
- Masukkan serbuk ke dalam Erlenmeyer 250 mL, cuci dengan 6 x 5 mL aseton selama 30 detik tiap kali pencucian
- Keringkan serbuk pada suhu 140°C selama 60 menit
- Timbang seksama 10 gram serbuk yang telah kering dan masukkan ke dalam Erlenmeyer 250 mL
- Tambahkan 50 mL WFI, tutup dengan rapat
- Masukkan ke dalam autoklaf, sterilisasi pada suhu 121°C selama 30 menit.
- Dinginkan labu lalu enap tuangkan air dalam labu, tampung
- Sisa serbuk dibilas dengan 4 x 15 mL WFI, kumpulkan hasil bilasan
- Tambahkan 5 tetes metil merah dan titrasi segera dengan H2SO4 0,02 N
B. Uji ketahanan kaca terhadap air pada suhu 121°C
- Pilih secara acak 3 atau lebih wadah yang telah dibilas 2x dengan WFI
- Isi wadah dengan WFI hingga 90% kapasitas penuh
- Masukkan ke dalam autoklaf, sterilisasi pada suhu 121°C selama 60 menit
- Tuangkan isi wadah ke dalam Erlenmeyer hingga volume 100 mL
- Tambahkan 5 tetes metil merah dan titrasi dalam keadaan hangat dengan H2SO4 0,02N
- Lakukan titrasi blanko menggunakan 100 mL WFI pada suhu dan indikator yang sama.
Untuk membuat agar kemasan gelas bersifat inert dan netral maka gelas dicelupkan dalam larutan asam. Untuk melinDungi permukaan gelas maka diberi laminasi silikon polietilen glikol atau polietilen stearat. Sifat gelas yang stabil menyebabkan gelas dapat disimpan dalam jangka waktu panjang tanpa kerusakan. Uji alkalinitas sangatlah penting karena gelas yang dipakai sebagai wadah untuk injeksi harus dapat menjaga pH larutan sehingga tidak menaikkan pH karena pengeluaran alkali, oleh karenanya gelas harus bersifat netral. Wadah yang telah mengalami perubahan fisika- kimia sehingga menyebabkan mungkin tidak lagi memenuhi syarat. Syarat yang lain untuk wadah sediaan injeksi yaitu untuk ampul harus mudah dilebur, pada waktu menutup ampul, tidak mudah pecah, dan untuk ampul pada waktu dipotong tidak mengeluarkan pecahan gelas yang lembut.
Judul : Pembuatan Injeksi (Pengemas Ampul Dan Vial)
Tujuan :
A. Uji Kejernihan
Telaah pustaka.
Uji Pirogenitas
Telaah pustaka. Hewan uji diganti tikus
PEMBAHASAN
Oleh karena pirogen cukup berbahaya jika terkontaminasi ke dalam tubuh manusia, maka dilakukanlah uji pirogenitas pada sediaan steril. Uji pirogenitas dimaksudkan untuk membatasi resiko reaksi demam yang dapat diterima oleh pasien apabila diinjeksi dengan suatu sediaan farmasi. Sampai saat ini, substansi pirogenik yang diketahui paling aktif dan paling sering mencemari sediaan farmasi adalah endoktoksin. Pada pengujian LAL untuk tes pirogenitas memiliki beberapa ketentuan yakni setiap penurunan suhu dianggap nol dan sediaan memenuhi syarat apabila tak seekor kelincipun menunjukkan kenaikan suhu 0,50 C atau lebih. Jika ada kelinci yang menunjukkan kenaikan suhu 0,50 C atau lebih lanjutkan pengujian dengan menggunakan 5 ekor kelinci. Jika tidak lebih dari 3 ekor dari 8 ekor kelinci masing-masing menunjukkan kenaikan suhu 0,50 C atau lebih dan jumlah kenaikan suhu maksimum 8 ekor kelinci tidak lebih dari 3,30 C sediaan dinyatakan memenuhi syarat bebas pirogen.
PEMBAHASAN
Pemberian infus kepada pasien dilakukan melalui intravena. Terapi intravena adalah tindakan yang dilakukan dengan cara memasukkan cairan, elektrolit, obat intravena dan nutrisi parenteral ke dalam tubuh melalui intravena. Tindakan ini sering kali merupakan tindakan life saving seperti saat kehilangan banyak cairan, dehidrasi dan syok. Pembuatan infus ringer laktat dibuat dengan sterilisasi akhir. Sediaan infus ringer laktat harus dibuat steril sebab berhubungan langsung dengan darah atau cairan tubuh serta jaringan tubuh yang pertahanannya terhadap zat asing tidak selengkap pada bagian lain tubuh seperti saluran cerna atau gastrointestinal. Dengan kondisi sediaan steril dan bebas mikroba maupun pirogen diharapkan terhindar dari adanya infeksi sekunder.
Tonisitas larutan perlu dihitung dahulu sebelum pembuatan sediaan, dengan tujuan agar dapat diketahui apakah larutan tersebut sudah isotonis atau belum, sebab hal itu berhubungan dengan tekanan osmose larutan terhadap cairan tubuh yang akan diberi larutan infus. Larutan yang isotonis adalah larutan larutan yang memiliki tekanan osmose sama dengan tubuh, dalam keadaan isotonis larutan yang diinjeksikan tidak akan menimbulkan rasa sakit. Sedangkan larutan yang hipotonis akan menimbulkan sel cairan tubuh akan pecah atau lisis, karena tekanan diluar sel lebih rendah, maka cairan dalam sel akan menggembung dan pecah, mengingat tekanan osmose berjalan dari cairan konsentrasi rendah (encer) ke cairan bertekanan tinggi (pekat) sebaliknya pada keadaan hipertonis akan mengakibatkan keadaan di luar sel lebih tinggi dibandingkan di dalam sel. Sehingga keadaan sel mengkerut. Keadaan hipotonis lebih berbahaya dibandingkan hipertonis, sebab larutan hipotonis bersifat irreversible (sel sudah pecah), sedangkan hipertonis bersifat reversible (sel dapat lembali normal).
- Mahasiswa mampu melakukan perhitungan isotonisitas dengan 3 macam metode yang berbeda
- Mahasiswa mampu memilih eksipien yang sesuai dengan zat aktif dan bentuk sediaan yang diformulasikan.
- Mahasiswa mampu membuat sediaan injeksi dengan pengemas ampul dan vial
PEMBAHASAN
Syarat tonisitas untuk sediaan injeksi ialah sedapat mungkin isotonis, dan larutan hipertonis untuk sediaan injeksi masih diperbolehkan karena volume yang diberikan sedikit , sehinggga sel yang menglami krenasi dapat kembali normal karena dinetralkan/imbangi oleh cairan tubuh yang lebih banyak. Namun bila hipotonis, terjadi lisis sel atau pecahnya sel, sehingga berbahaya. ntuk mencegah masuknya partikel yang tidak diinginkan ke dalam produk parenteral, sejumlah tindakan pencegahan harus dilakukan selama pembuatan dan penyimpanan. Misalnya, larutan parenteral umumnya pada akhirnya disaring sebelum dimasukkan ke dalam wadah. Hal yang melatarbelakangi dalam pembuatan sediaan injeksi ampul adalah untuk member bantuan kepada para pasien yang dalam keadaan tidak sadar yang tidak dapat diberikan secara peroral. Sehingga diberikan pemberian obat secara injeksi ampul. Disisi lain, penggunaan injeksi ampul bertujuan untuk memberikan kerja obat yang lebih cepat, maka efek yang diinginkan dari pemberian injeksi tersebut lebih cepat pula.
❤ Judul : Kontrol Kualitas Sediaan Injeksi
Tujuan :- Mahasiswa mampu memahami proses kontrol kualitas sediaan injeksi
- Mahasiswa mampu menganalisis tujuan dan fungsi kontrol kualitas sediaan injeksi
- Mahasiswa setelah melakukan pengujian kontrol kualitas dapat menyimpulkan sediaan injeksi memenuhi persyaratan kualitas atau tidak.
A. Uji Kejernihan
- Ambil 4 ampul dan 4 vial
- Amati di dekat lampu 50 watt. Putar sediaan 360o dan goncang perlahan.
- Catat adakah partikel mengambang
- Siapkan bejana dengan memasukkan akuades hingga memenuhi ¾ bejana. Catat volume akuades yang digunakan.
- Masukkan cairan metilen biru dengan kadar 1%. Aduk hingga merata.
- Ambil 3 buah ampul dan 3 buah vial dan masukkan ke dalam bejana. Jika mengapung gunakan pemberat.
- Setelah 30 menit keluarkan ampul dan vial, amati cairan di dalam sediaan.
- Buka penutup vial dan patahkan leher ampul (1 buah)
- Dengan menggunakan spuit injeksi, sedot cairan dari dalam wadah.
- Catat berapa volume yang ada di dalam sediaan.
- Untuk ampul, dari hasil pengujian volume, sedot 0,5 – 1 mL cairan.
- Teteskan pada kertas pH Merck®
- Bandingkan dengan indikator, catat pH.
- Untuk vial, gunakan semua cairan (25 mL), masukkan ke gelas beker kecil yang telah dibersihkan sebelumnya.
- Hidupkan pH meter dan celupkan stick pH meter di dalam larutan injeksi.
- Catat pH yang teramati
Telaah pustaka.
Uji Pirogenitas
Telaah pustaka. Hewan uji diganti tikus
PEMBAHASAN
Oleh karena pirogen cukup berbahaya jika terkontaminasi ke dalam tubuh manusia, maka dilakukanlah uji pirogenitas pada sediaan steril. Uji pirogenitas dimaksudkan untuk membatasi resiko reaksi demam yang dapat diterima oleh pasien apabila diinjeksi dengan suatu sediaan farmasi. Sampai saat ini, substansi pirogenik yang diketahui paling aktif dan paling sering mencemari sediaan farmasi adalah endoktoksin. Pada pengujian LAL untuk tes pirogenitas memiliki beberapa ketentuan yakni setiap penurunan suhu dianggap nol dan sediaan memenuhi syarat apabila tak seekor kelincipun menunjukkan kenaikan suhu 0,50 C atau lebih. Jika ada kelinci yang menunjukkan kenaikan suhu 0,50 C atau lebih lanjutkan pengujian dengan menggunakan 5 ekor kelinci. Jika tidak lebih dari 3 ekor dari 8 ekor kelinci masing-masing menunjukkan kenaikan suhu 0,50 C atau lebih dan jumlah kenaikan suhu maksimum 8 ekor kelinci tidak lebih dari 3,30 C sediaan dinyatakan memenuhi syarat bebas pirogen.
❤ Judul : Pembuatan Infus
Tujuan :
- Mahasiswa mampu memahami perbedaan infus dan sediaan parenteral lainnya
- Mahasiswa mampu memahami konsep isotonisitas pada sediaan infus
- Mahasiswa mampu memilih eksipien yang digunakan dalam pembuatan sediaan infus
- Mahasiswa mampu melakukan formulasi sediaan infus
PEMBAHASAN
Pemberian infus kepada pasien dilakukan melalui intravena. Terapi intravena adalah tindakan yang dilakukan dengan cara memasukkan cairan, elektrolit, obat intravena dan nutrisi parenteral ke dalam tubuh melalui intravena. Tindakan ini sering kali merupakan tindakan life saving seperti saat kehilangan banyak cairan, dehidrasi dan syok. Pembuatan infus ringer laktat dibuat dengan sterilisasi akhir. Sediaan infus ringer laktat harus dibuat steril sebab berhubungan langsung dengan darah atau cairan tubuh serta jaringan tubuh yang pertahanannya terhadap zat asing tidak selengkap pada bagian lain tubuh seperti saluran cerna atau gastrointestinal. Dengan kondisi sediaan steril dan bebas mikroba maupun pirogen diharapkan terhindar dari adanya infeksi sekunder.
Tonisitas larutan perlu dihitung dahulu sebelum pembuatan sediaan, dengan tujuan agar dapat diketahui apakah larutan tersebut sudah isotonis atau belum, sebab hal itu berhubungan dengan tekanan osmose larutan terhadap cairan tubuh yang akan diberi larutan infus. Larutan yang isotonis adalah larutan larutan yang memiliki tekanan osmose sama dengan tubuh, dalam keadaan isotonis larutan yang diinjeksikan tidak akan menimbulkan rasa sakit. Sedangkan larutan yang hipotonis akan menimbulkan sel cairan tubuh akan pecah atau lisis, karena tekanan diluar sel lebih rendah, maka cairan dalam sel akan menggembung dan pecah, mengingat tekanan osmose berjalan dari cairan konsentrasi rendah (encer) ke cairan bertekanan tinggi (pekat) sebaliknya pada keadaan hipertonis akan mengakibatkan keadaan di luar sel lebih tinggi dibandingkan di dalam sel. Sehingga keadaan sel mengkerut. Keadaan hipotonis lebih berbahaya dibandingkan hipertonis, sebab larutan hipotonis bersifat irreversible (sel sudah pecah), sedangkan hipertonis bersifat reversible (sel dapat lembali normal).
❤ Judul : Pembuatan Tetes Mata
Tujuan :
- Mahasiswa mampu memahami konsep formulasi sediaan tetes mata
- Mahasiswa mampu memahami cara kerja sediaan optalmik
- Mahasiswa mampu memilih eksipien yang digunakan dalam pembuatan sediaan tetes mata
- Mahasiswa mampu melakukan perhitungan eksipien dan tonisitas untuk sediaan tetes mata
- Mahasiswa mampu melakukan formulasi sediaan tetes mata serta memilih metode sterilisasi yang tepat.
A. Analisis Fisik
Pembuatan tetes mata pada dasarnya dilakukan pada kondisi kerja aseptik dimana penggunaan air yang sempurna serta material wadah dan penutup yang diproses dulu dengan anti bakterial menjadi sangat penting. Obat mata digunakan untuk menghasilkan efek diagnostik dan terapetik lokal, dan yang lain untuk merealisasikan kerja farmakologis, yang terjadi setelah berlangsungnya penetrasi bahan obat dalam jaringan yang umumnya terdapat disekitar mata. Pada umumnya bersifat isotonis dan isohidris. Pembawa air yang digunakan adalah a.p.i (aqua pro injeksi). Pada formulasinya ditambahakan zat tambahan Natrium Cloridum (NaCl), karena jika tidak ditambahkan NaCl obat tetes mata tidak memenuhi syarat yaitu hipotonis. Jika larutan obat tetes mata dalam keadaan hipotonis disuntikan ke tubuh manusia akan berbahaya karena menyebabkan pecahnya pembuluh darah. Semua alat-alat harus disterilisasikan agar mendapatkan larutan yang steril, bebas partikel asing dan mikroorganisme. Agar obat tetes mata dan cuci mata nyaman dan tidak pedih dimata saat digunakan maka harus dibuat isotonis dengan penambahan NaCl.
Pembuatan sediaan gel ini dilakukan steril dengan tahap sterilisasi awal dan akhir. Pentingnya dilakukan sterilisasi selama proses pembuatan gel karena sediaan ini berfungsi sebagai sediaan antibakteri. Hand sanitizer berbasis alkohol lebih efektif membunuh sebagian mikroorganisme dibandingkan dengan sabun. Kadar alkohol bervariasi antara 60-85%. Alkohol dapat membunuh sebagian besar bakteri, jamur dan beberapa virus. Alkohol rub sanitizer yang mengandung setidaknya 70% alkohol (terutama etil alkohol) dapat membunuh 99,9 % dari bakteri di tangan selama 30 detik setelah aplikasi dan 99,99% dalam 1 menit.
- Uji kejernihan (FI IV, hal 998)
- Penentuan bobot jenis (FI IV, 1030)
- Penentuan pH (FI IV, hal 1039)
- Penentuan bahan partikulat (FI IV, hal 981)
- Penentuan volume terpindahkan (FI IV, hal 1089)
Volume pada etiket (ml) Volume tambahan yang dianjurkan Cairan encer (ml) Cairan kental (ml) 0,9 0,1 0,12 1,0 0,1 0,15 2,0 0,15 0,25 5,0 0,30 0,50 10,0 0,50 0,70 - Penentuan viskositas dan aliran (diktat praktikum farmasi fisika hal 9, 10, 14)
- Stabilitas zat aktif
- Zat harus stabil selama proses pembuatan terutama saat sterilisasi dan stabilitas pada waktu penyimpanan sampai waktu tertentu.
- Penetapan kadar
- Penentuan potensi (untuk antibiotic)
- Uji sterilitas
- Memenuhi uji sterilisasi seperti yang tertera pada uji keamanan hayati (FI edisi III)
- Uji efektivitas pengawet (FI IV, hal 854-855)
Pembuatan tetes mata pada dasarnya dilakukan pada kondisi kerja aseptik dimana penggunaan air yang sempurna serta material wadah dan penutup yang diproses dulu dengan anti bakterial menjadi sangat penting. Obat mata digunakan untuk menghasilkan efek diagnostik dan terapetik lokal, dan yang lain untuk merealisasikan kerja farmakologis, yang terjadi setelah berlangsungnya penetrasi bahan obat dalam jaringan yang umumnya terdapat disekitar mata. Pada umumnya bersifat isotonis dan isohidris. Pembawa air yang digunakan adalah a.p.i (aqua pro injeksi). Pada formulasinya ditambahakan zat tambahan Natrium Cloridum (NaCl), karena jika tidak ditambahkan NaCl obat tetes mata tidak memenuhi syarat yaitu hipotonis. Jika larutan obat tetes mata dalam keadaan hipotonis disuntikan ke tubuh manusia akan berbahaya karena menyebabkan pecahnya pembuluh darah. Semua alat-alat harus disterilisasikan agar mendapatkan larutan yang steril, bebas partikel asing dan mikroorganisme. Agar obat tetes mata dan cuci mata nyaman dan tidak pedih dimata saat digunakan maka harus dibuat isotonis dengan penambahan NaCl.
❤ Judul : Pembuatan Gel Hand Sanitizer Dan Sabun Steril
Tujuan :
- Mahasiswa mampu memahami dan memilih eksipien yang sesuai dengan zat aktif dan bentuk sediaan yang digunakan untuk formulasi steril.
- Mahasiswa mampu membuat sediaan gel Hand sanitizer dan sabun steril dengan metode sterilisasi yang sesuai.
Pembuatan sediaan gel ini dilakukan steril dengan tahap sterilisasi awal dan akhir. Pentingnya dilakukan sterilisasi selama proses pembuatan gel karena sediaan ini berfungsi sebagai sediaan antibakteri. Hand sanitizer berbasis alkohol lebih efektif membunuh sebagian mikroorganisme dibandingkan dengan sabun. Kadar alkohol bervariasi antara 60-85%. Alkohol dapat membunuh sebagian besar bakteri, jamur dan beberapa virus. Alkohol rub sanitizer yang mengandung setidaknya 70% alkohol (terutama etil alkohol) dapat membunuh 99,9 % dari bakteri di tangan selama 30 detik setelah aplikasi dan 99,99% dalam 1 menit.
❤Praktikum Tekfar steril ada pada link berikut :


Tidak ada komentar:
Posting Komentar